美国研究发现:调控蛋白CD22可增强大脑小胶质细胞清理功能
如果一座城市的垃圾处理站出了故障,肯定会飘“臭”万里,搅得居民不得安生。而如果一个人身体里的“垃圾处理站”出了问题,身体的各项功能就会受到影响。尤其是大脑里,垃圾累积得多了,脑子就会变得“迟钝”,阿尔茨海默病、帕金森病这些神经退行性疾病,都和大脑中的“垃圾”蛋白累积脱不开关系。
小胶质细胞是大脑中的重要免疫细胞,担当了清洁重任。小胶质细胞出了问题,该怎么维修呢?
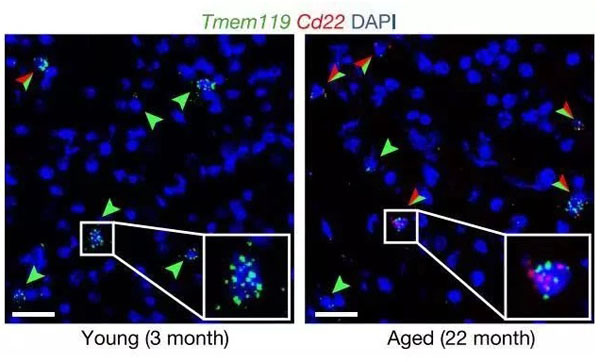
绿色:小胶质细胞;红色:CD22
斯坦福大学的Tony Wyss-Coray博士和他的团队在顶级期刊《自然》上发表了重磅研究成果,他们成功找到了调控小胶质细胞“清洁”能力的蛋白CD22,抑制CD22可以恢复衰老小鼠小胶质细胞的清理功能,减少阿尔茨海默病小鼠和帕金森病小鼠大脑中的“垃圾”蛋白,改善小鼠的认知。
小胶质细胞这家垃圾站,存在时间很长,在几乎全部的生命周期里都发挥着无可取代的重要作用。在大脑的发育过程中,如果神经元连接或者蛋白质出现了错误,就需要小胶质细胞来把它们清理掉。在神经退行性疾病和其他衰老有关的疾病中,小胶质细胞的正常清理功能被严重干扰,好好工作的蛋白平白无故被“吃掉”,该清理的错误蛋白却不清理,大量的髓磷脂碎片和蛋白质聚积,愁坏了一波又一波的科研人员。
系统故障,又不能重启,怎么办?
在小胶质细胞的漫长工作生涯中,各种基因的转录水平也随着年龄不断发生变化[6,7],但是这些基因各自的职责范围还没人仔细研究过。Wyss-Coray博士决定从细节入手,一个基因一个基因地研究。Wyss-Coray博士挑了大概3000个编码蛋白质的基因,把它们挨个敲除,发现敲除CD22蛋白的基因可以显著促进小鼠小胶质细胞的吞噬作用。
进一步的实验表明,衰老小鼠小胶质细胞表面的CD22表达量是年轻小鼠的3倍!是个妥妥的衰老相关表型。表达CD22的小胶质细胞在年轻的大脑里几乎没有,但是在老年大脑中那就是满天繁星。把小胶质细胞和CD22分别用荧光标记之后,研究人员还发现,在小鼠的中枢神经系统中,似乎只有小胶质细胞表达CD22。这就好办多了,抑制CD22,也不怕对别的细胞产生什么影响。
研究人员给小鼠的大脑注射了CD22抗体和免疫球蛋白(IgG),评估它们的对小胶质细胞清除能力的影响。48小时后,与IgG相比,CD22抗体治疗显著增加了衰老小鼠小胶质细胞的吞噬能力,并且不会对年轻小鼠的中枢神经系统造成显著影响。敲除CD22基因可以起到同样的效果。
在阿尔茨海默病模型小鼠和帕金森病模型小鼠中,CD22抗体的加入同样可以促进小胶质细胞的吞噬作用,不论是β淀粉样蛋白还是α突触核蛋白纤维,数量都明显减少,这二者分别是阿尔茨海默病和帕金森病的典型特征。
同时,阻断CD22还可以能够“挽留”小胶质细胞的青春,帮助其维持稳态。给小鼠的大脑连续注射CD22抗体一个月,小胶质细胞的基因表达状况明显要比那些注射IgG或是未处理的对照组小鼠更“年轻化”,与海马体损伤有关的趋化因子表达量更少。海马体受到了保护,时间就会对小鼠异常温柔了,即使年华老去,记忆力、学习能力都会好过未经CD22抗体治疗的小鼠。
总结起来就是,CD22是小胶质细胞吞噬作用的负调控因子,随着衰老而表达上调,抑制小胶质细胞的吞噬作用,导致“垃圾站”停工歇业,影响大脑正常功能。抑制CD22可以延缓衰老相关的功能减退和神经退行性疾病。
想让时光慢些,唱歌不管用,CD22兴许管用
但是,CD22并不是个完全的反面角色。小鼠出生7天后,CD22就会在小胶质细胞中出现,防止小胶质细胞胡乱“开炮”,把那些没有发育完全的神经元也清理掉。但是,在衰老过程中,这种保护机制被错误地激活,反倒让髓磷脂碎片和“垃圾”蛋白占领了“高地”。(奇点网 文/王雪宁)
参考文献:
[1] John V. P, Michael S. H, Benjamin A. H, et al. CD22 blockade restores homeostatic microglial phagocytosis in ageing brains.[J]. Nature, 2019.DOI:10.1038/s41586-019-1088-4
[2] Fuger P, Hefendehl J K, Veeraraghavalu K, et al. Microglia turnover with aging and in an Alzheimer's model via long-term in vivo single-cell imaging[J]. Nature Neuroscience, 2017, 20(10): 1371-1376.DOI:10.1038/nn.4631
[3] Reu P, Khosravi A, Bernard S, et al. The Lifespan and Turnover of Microglia in the Human Brain[J]. Cell Reports, 2017, 20(4): 779-784.DOI:10.1016/j.celrep.2017.07.004
[4] Hong S, Bejaglasser V F, Nfonoyim B M, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models[J]. Science, 2016, 352(6286): 712-716.DOI:10.1126/science.aad8373
[5] Lui H, Zhang J, Makinson S R, et al. Progranulin deficiency promotes circuit-specific synaptic pruning by microglia via complement activation[J]. Cell, 2016, 165(4): 921-935.DOI:10.1016/j.cell.2016.04.001
[6] Hickman S E, Kingery N D, Ohsumi T K, et al. The microglial sensome revealed by direct RNA sequencing[J]. Nature Neuroscience, 2013, 16(12): 1896-1905.DOI:10.1038/nn.3554
[7] Grabert K, Michoel T, Karavolos M H, et al. Microglial brain region?dependent diversity and selective regional sensitivities to aging[J]. Nature Neuroscience, 2016, 19(3): 504-516.DOI:10.1038/nn.4222
北京航空总医院神经外科中心 咨询电话:15311449806
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣






